Technologies des anticorps monoclonaux
L'intérêt de l'utilisation d'anticorps en thérapeutique n'est plus à démontrer. Les technologies d'obtention de molécules spécifiques et de banques combinatoires se font de jour en jour plus performantes.
L'obtention d'anticorps monoclonaux de spécificité prédéfinie a permis, dès 1975, de disposer d'un outil exceptionnel pour la recherche fondamentale (définition et caractérisation fonctionnelle de nombreuses molécules et cellules et pour le diagnostic in vitro).
Cependant, malgré les efforts considérables déployés ces deux dernières décennies, l'utilisation in vivo d'anticorps monoclonaux à des fins diagnostiques et thérapeutiques s'est avérée très limitée par:
- la nature des anticorps (la plupart du temps d'origine murine),
- leur stabilité et leur affinité plus ou moins bonnes,
- leur taille ainsi que leur faible capacité à atteindre le compartiment tissulaire visé. H
L'ingénierie des anticorps connaît un essor spectaculaire depuis le début des années quatre-vingt.
Au début des années quatre-vingt, il devenait évident que la mise au point d'une nouvelle génération d'anticorps, modifiés chimiquement ou par génie génétique, serait nécessaire pour résoudre certains de ces problèmes. L'ingénierie des anticorps a dès lors connu un développement spectaculaire:
- D'une part, la technique de PCR (polymerase chain reaction) a permis le clonage rapide de régions variables lourdes et légères VH et VL et leur expression sous forme de fragments Fab ou simple chaîne (scFv pour single chain Fv, c'est-à-dire une région VH et une région VL liées l'une à l'autre par un peptide).
- D'autre part, l'émergence de techniques permettant l'expression de peptides ou de protéines hétérologues à la surface de bactériophages a permis de construire des banques combinatoires de régions VH/VL, naturelles ou semisynthétiques, et de sélectionner les combinaisons d'intérêt.
Il est ainsi devenu possible de sélectionner des fragments d'anticorps humains, de modifier leur affinité, voire leur spécificité, et de construire rapidement des molécules chimériques (fragments d'anticorps Fab ou scFv liés à des enzymes, des cytokines, des toxines ou des précurseurs de médicaments) ou des anticorps bispécifiques. Il existe aujourd'hui différentes stratégies permettant de construire des banques combinatoires.
Comment disposer d'anticorps monoclonaux spécifiques?
Les banques de fragments d'anticorps et de peptides
Une approche très efficace pour obtenir des banques de très grandes tailles consiste à recombiner deux banques distinctes de régions VH et VL. Pratiquement, il s'agit d'infecter un répertoire de chaînes légères par un répertoire de chaînes lourdes, ou vice-versa, et d'utiliser ensuite, soit la recombinase Cre du phage P1, soit l'intégrase du phage l pour créer une association physique des deux répertoires. Théoriquement, ces stratégies rendent possible la construction de banques de Fab ou de scFv d'une grande diversité (1011-1012 clones différents).
De telles banques sont utilisées avec succès pour sélectionner des fragments spécifiques d'antigènes. Par exemple, on peut sélectionner des fragments Fab dirigés contre la protéine gp120 du VIH via un vecteur de clonage et d'expression. Cette glycoprotéine est impliquée dans la reconnaissance des cellules cibles du virus (les lymphocytes T4), à partir d'une banque combinatoire établie en utilisant des lymphocytes du sang périphérique d'un donneur séropositif.
De même, on peut obtenir des fragments Fab par sélection de banques combinatoires construites à partir d'ARNm issus de cellules de moelle osseuse de chimpanzés immunisés avec le VIH ou avec différentes préparations de protéines recombinantes. Plusieurs clones, issus de tels criblages, montrent un effet inhibiteur sur la réplication virale in vitro et pourraient constituer de puissants outils neutralisant le VIH. Ce n'est pas le cas à cause de ce que nous avons dit plus haut G .
Une autre solution permettant d'obtenir des molécules neutralisant le VIH consiste à isoler des peptides mimotopes d'épitopes des protéines rev, tat et de la gp160 à partir d'une banque de peptides de 20 résidus exprimés sur la protéine III du phage fd.
La construction de banques d'hexapeptides et de décapeptides exprimés à la partie N-terminale de la protéine III, construites de manière aléatoire, a permis d'isoler des peptides mimotopes du polysaccharide de Cryptococcus neoformans, champignon unicellulaire responsable d'attaques chroniques du système nerveux et de méningites aiguës chez les individus immunodéprimés, en particulier ceux touchés par le sida. Ces peptides sont actuellement étudiés pour leur capacité à induire une protection contre l'infection par Cryptococcus neoformans chez la souris.
Une seconde possibilité, qui n'a cependant pas encore connu de développement important à ce jour, est d'utiliser une technique de PCR intracellulaire. Dans ce cas, il est possible d'obtenir des banques représentant le répertoire naturel d'anticorps non recombinés in vitro en associant la région VH avec la région VL qui lui est appariée dans le lymphocyte B.
Une troisième alternative consiste à dériver des fragments d'anticorps (Fab ou scFv) à partir de lignées B déjà établies et bien caractérisées du point de vue de leur spécificité. Le clonage de régions VL et VH à partir hybridomes murin de lignées B humaines déjà établis reste cependant complexe (du fait par exemple, de la présence de différentes régions réarrangées).
Un autre problème fréquemment rencontré, lié aux nombreux cycles de PCR nécessaires à la construction du scFv est celui de la perte de la reconnaissance de l'antigène du fait d'une erreur de copiage lors des étapes de PCR. En fait, ces problèmes peuvent souvent être résolus par clonage préliminaire d'un fragment d'ADNc comprenant la séquence signal, la région VH et une partie de la région constante afin d'éviter le clonage de régions variables non spécifiques mais présentes dans l'hybridome de départ. Ou encore par la construction d'une banque de regions variables à partir de l'hybridome, suivie de la sélection des bactériophages exprimant le scFv liant effectivement l'antigène. Ceci a été effectué dans le cas d'un anticorps anti-acétylaminofluorene (AAF: molécule qui, couplée aux acides nucléiques, est utilisée comme sonde non radioactive en association avec un anticorps anti-AAF couplé à une enzyme dont le scFv initial avait perdu son affinité pour l'AAF.
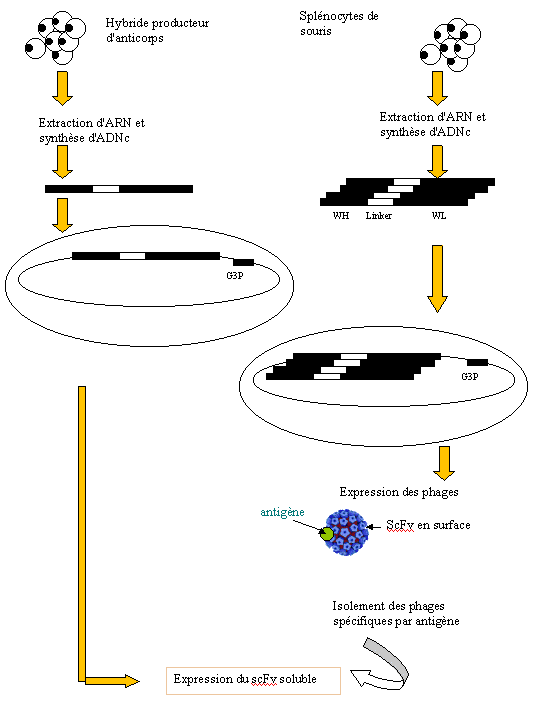
- FIG 1: Obtention d'un fragment d'anticorps.Représentation schématique de l'obtention d'un fragment d'anticorps scFv à partir, soit d'un hybridome produisant un anticorps monoclonalpréalablement caractérisé, soit d'une banque de phages dérivée de splénocytes de souris immunisées ou non.
Modification de l'affinité et de la spécificité d'anticorps
L'emploi de la technique d'expression de fragments d'anticorps à la surface des bactériophages constitue aussi un outil puissant pour analyser voire modifier, l'affinité et/ou la spécificité de reconnaissance d'un anticorps. Par exemple. deux scFv anticortisol présentant des réactions croisées différentes vis-à-vis d'analogues stéroidiens de ce dernier ont été clonés à partir hybridomes B et séquencés. Des modèles de structure tridimensionnelle ont été alors établis à partir des séquences primaires, permettant l'identification de cinq ou six acides amines impliqués dans l'interaction entre les sites de liaison et le cortisol. Le criblage d'une banque de scFv mutants, exprimés à la surface des bactériophages sous forme de protéine de fusion (avec la protéine III du phage) à l'aide de différents analogues stéroïdiens, a alors permis d'obtenir des scFv de spécificité plus fine.
Et demain ?
Mais que peut-on donc raisonnablement espérer de ces fragments d'anticorps? Diverses perspectives d'applications diagnostiques ou thérapeutiques sont actuellement explorées.
Les anticorps dans les trousses de diagnostic...
L'utilisation dans des tests Elisa de préparations de bactériophages exprimant a leur surface un scFv dirigé contre la digoxine.
Un hétéroside cationique utilisé pour le traitement de l'insuffisance cardiaque a été proposée comme substitut à l'utilisation de l'anticorps parental pour réaliser l'immunodosage de cette molécule, ainsi que celui de ses métabolites actifs. Cette approche préserve la spécificité et la sensibilité du dosage et permet non seulement de s'affranchir des étapes de purification des anticorps, mais aussi d'utiliser des fragments d'anticorps sélectionnés à partir de banques combinatoires, produits rapidement et particulièrement stables à la surface des bactériophages. De même, la possibilité qu'offrent les banques combinatoires de cloner rapidement des fragments d'anticorps dans des vecteurs d'expression permettant la fusion des séquences d'ADN de ces fragments avec celles codant pour des enzymes telles que la phosphatase alcaline permet de générer des réactifs immuno-enzvmatiques sans couplage biochimique préalable.
... ou dans l'arsenal thérapeutique
Dans ce domaine, l'utilisation de fragments d'anticorps recombinants pose des questions spécifiques: type de fragments à utiliser (scFv monovalents ou multivalents, anticorps chimériques), systèmes de production et stratégies d'utilisation in vivo. Différents modèles sont développés. Des anticorps recombinants anti-rhésus D sont testés comme substituts aux anticorps polyclonaux utilisés pour prévenir le risque de sensibilisation anti-RhD+ chez les femmes enceintes RhD- (par masquage de l'antigène dû à l'opsonisation des globules rouges fœtaux et/ou par des mécanismes effecteurs inhibant la réponse immune). L'incompatibilité Rhésus entre la mère et son enfant conduit en effet à la maladie hémolytique du nouveau-né. L'efficacité fonctionnelle (activation de la cascade du complément, fixation aux RFcg des cellules macrophagiques et Cytotoxiques) d'un anticorps où les régions VH et VL ont été associées à différentes régions constantes d'IgG humaines est actuellement évaluée. L'affinité médiocre des scFv anti-RhD disponibles pourrait être compensée par l'association de la séquence C-terminale de la C4BP à ces derniers, une protéine de la cascade du complément l'homomultimérisation du scFv qui en résulte permet une forte liaison aux globules rouges RhD+. De tels multimères pourraient être utilisés in vivo pour un "masquage" plus efficace de l'antigène RhD. Enfin, les quantités d'anticorps recombinants anti-RhD nécessaires pour traiter l'incompatibilité RhD à grande échelle pourraient être obtenues en utilisant des cellules d'insectes infectées par des baculovirus recombinants.
La recherche sur les anticorps à usage thérapeutique s'oriente aussi vers le développement de fragments scFv bispécifiques (diabodies, ou dianticorps) permettant le pontage de cellules tueuses (par exemple des cellules T CD3+ ou des cellules NK CD16+) à des cellules cibles exprimant un antigène associé aux tumeurs (par exemple l'ACE, antigène carcinomo-embryonnaire, spécifique de cellules cancéreuses). L'approche utilisée consiste à raccourcir le peptide liant la région VH et VL des scFv d'intérêt, à inverser l'ordre des régions VH et VL (VH de l'un des anticorps parentaux associé au VL de l'autre) des scFv et à insérer leurs séquences dans un vecteur bicistronique. Les molécules obtenues sont bispécifiques, chaque scFv ne pouvant se replier sur lui-même et s'associant tête- bêche avec l'autre. Elles se fixent aux cellules exprimant les antigènes cibles et sont capables de favoriser une action cytotoxique. Mais de gros problèmes de stabilité et d'hétérogénéité moléculaires restent à résoudre. Une autre approche permet le recrutement d'effecteurs cytotoxiques l'expression à la surface de cellules T (T-bodies) de fragments scFv liés à une séquence intracytoplasmique capable de transduire des signaux d'activation des lymphocytes (par exemple, la chaîne x du récepteur des lymphocytes T). Les cellules obtenues ont, in vitro, une activité cytotoxique non restreinte par le complexe majeur d'histocompatibilité (CMH) car la spécificité de liaison aux cellules cibles n'est fonction que des régions VH et VL du scFv.
Les scFv constituent aussi un outil potentiel pour modifier le tropisme de rétrovirus ou d'adénovirus recombinants, ce qui autorise un ciblage cellulaire sélectif, permettant l'entrée du matériel viral contenant un gène d'intérêt. Ainsi, l'insertion d'un scFv dirigé contre les molécules de classe I du CMH humain à l'extrémité N-terminale de la glycoprotéine d'enveloppe du rétrovirus murin MoMuLV (virus lymphotropique murin de Moloney) permet de modifier le tropisme du virus et donc d'infecter des cellules humaines.
Enfin, l'expression intracellulaire de scFv est un outil antiviral ou antitumoral puissant. Ainsi, l'expression d'un scFv dirigé contre la protéine gag du rétrovirus MoMuLV dans des fibroblastes de souris infectées induit une inhibition significative de la production de particules virales. Cette expression intracellulaire de fragments d'anticorps peut être dirigée dans différents compartiments cellulaires : réticulum endoplasmique, cytosol ou noyau. Malgré un environnement chimique très réducteur, l'expression dans le cytosol permet l'obtention de molécules fonctionnelles capables d'interagir avec des molécules exprimées dans ce compartiment. On peut ainsi envisager la reconnaissance de p21ras (une protéine localisée sur la face interne de la membrane plasmique) par un anticorps neutralisant exprimé sous forme de scFv associé à une séquence d'adressage adéquate permettant de cibler spécifiquement la membrane plasmique. Il s'agit d'une approche thérapeutique potentielle pour le traitement des tumeurs dans lesquelles la molécule p21ras mutée est oncogénique.
Un réseau de compétences dans l'ingénierie moléculaire des anticorps recombinants se constitue en France. Ce réseau informel, qui s'est cristallisé lors d'un colloque en 1995 rassemble la plupart des groupes français engagés dans le développement de banques combinatoires et dans l'utilisation de scFv à des fins diagnostiques ou thérapeutiques. Il vise à favoriser des échanges dont on ne peut qu'espérer des retombées fructueuses pour la mise au point de nouvelles techniques d'obtention de fragments d'anticorps recombinants, mais aussi de nouvelles stratégies d'utilisation diagnostique et thérapeutique. À tous les participants de le faire vivre!
Sommaire | Protocole technique d'obtention des Hybridomes |
