Figure: Microscopie électronique de phages T4 adsorbés à la surface d'Escherichia coli ;on remarquera que le phage central a déjà inoculé son ADN.
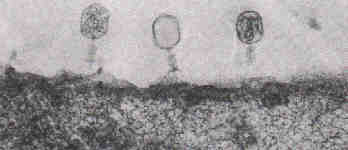
Table des matières de cette page:
| Les papillomavirus de type 16 | Références sur les HPV | |
| L'analyse génétique chez les virus | Allélisme et complémentation | |
| Les réversions génétique virales | Les virus peuvent se croiser | |
Figure: Microscopie électronique de phages T4 adsorbés à la surface d'Escherichia coli ;on remarquera que le phage central a déjà inoculé son ADN. |  |
Les virus sont les organismes vivants les plus simples que l'on connaisse. En schématisant un peu, on dira qu'ils sont constitués de deux parties : d'une part, une enveloppe de nature protéique et, d'autre part, un chromosome constitué d'un acide nucléique, ADN ou ARN, selon les cas. La figure ci-dessus montre l'infection d'E. coli par un virus, le bactériophage T4 (ou phage T4). La capsule (enveloppe) protéique de ce virus renferme le chromosome. Le génome du phage T4 est une double hélice d'ADN refermée sur elle-même en un cercle. Le virus à l'état libre n'est constitué que de celle-ci. Sous cette forme, il n'a rien de vivant on n'observe ni activité métabolique (pas de respiration, pas de synthèses), ni multiplication, ni reproduction. Mais cette particule inerte peut infecter la Bactérie E. coli en se fixant à la surface de la cellule bactérienne et en lui injectant son chromosome. Cela détermine, à l'intérieur de la Bactérie, la multiplication et la maturation de plusieurs centaines de nouveaux phages qui, à la fin du cycle de multiplica-tion, sont libérés dans le milieu extérieur par la lyse de la Bactérie.
Pour manipuler ces minuscules organismes. visibles seulement au microscope électronique, on opère souvent avec des boîtes de Pétri contenant un milieu nutritif solidifié par l'addition d'agar-agar. Ce milieu est ense-mencé avec une suspension de Bactéries dont la concen-tration est telle qu'au bout de quelques générations cellulaires il se forme un "tapis" bactérien, très reconnais-sable car il opacifie superficiellement le milieu de culture. On étale sur cette culture une suspension virale. Les virus vont infecter les Bactéries et s'y multiplier pour donner des centaines de descendants, qui seront libérés par la lyse des Bactéries en un temps très court (de 15 à 60 minutes). Chaque nouveau virus peut infecter une Bactérie et s'y multiplier à son tour. Après un certain nombre de cycles infectieux, toutes les Bactéries proches du virus initial sont lysées. Il y a donc formation de zones de lyse qui apparaissent comme des trous dans le tapis bactérien opaque (plages de lyse).
On peut se servir de cette méthode pour connaître la concentration en phages d'une suspension; il est néces-saire de pouvoir compter le nombre de plages de lyse qui résultent de l'étalement d'un volume connu de la suspension sur un tapis bactérien. Pour ce faire, on est obligé d'immobiliser les phages et les Bactéries sur la boîte ou, du moins, de freiner fortement leur diffusion. A cette fin, on n'ensemence pas directement la ou les boîtes par les Bactéries d'une part et par une suspen-sion virale d'autre part. Mais, on prépare un mélange d'un grand nombre de Bactéries sensibles au phage et d'un petit nombre de particules virales, dans un petit volume de gélose (agar-agar) maintenu en surfusion (46 °C). On répand ensuite ce mélange sur les boîtes de culture, que l'on met à incuber à la température normale de culture (37 °C). A cette température. la gélose se solidifie et freine la diffusion des phages et des Bactéries, ce qui permet d'obtenir des plages de lyse bien délimitées et rend possible une interprétation quantitative des résul-tats. Si les concentrations respectives en virus et en Bactéries ont été bien choisies, on peut alors déterminer le nombre de particules formant plage qui existaient à l'origine dans la suspension virale.
Il existe des mutants, dits [rII], dont le phénotype présente un cycle de lyse plus rapide que celui du type "sauvage"; c'est-à-dire qu'au bout d'un même temps, les plages dues à un mutant [rII] sont plus grandes que celles dues à un phage [rII]. Les virus rII et rII+ sont tous deux capables d'infecter des Bactéries E. coli de la souche B. Par contre, seuls les phages rII+ peuvent se multiplier sur les Bactéries de la souche K12. Notons, pour la suite, le génotype de la souche "sauvage" rII+ et les génotypes des différentes souches mutantes r111, r112, r113,..., rIIx.
On possède plusieurs milliers de souches mutantes [rII], obtenues indépendamment, soit spontanément, soit au cours de mutagenèses. La première chose à faire est d'observer la descendance d'un virus mutant nouvelle-ment isolé et dont on ne sait qu'une chose: il présente le phénotype rII. Le principe de cette expérience peut se résumer de la façon suivante : on prépare un tube à essais contenant du milieu nutritif liquide où l'on a mis à incuber des Bactéries sensibles (E. coli). On ajoute alors un petit volume d'une suspension contenant les phages à étudier. Les virus infectent les Bactéries et s'y multiplient. Après un court laps de temps (de 15 à 60 mn, selon les conditions expérimentales), les Bactéries infectées se lysent et libèrent les virus descendants. Pour disposer d'une suspension qui ne contienne que des phages, on ajoute quelques gouttes de chloroforme (corps qui a la propriété de lyser les Bactéries et d'être sans action sur les particules virales libres). On peut alors tester la récolte de phages en l'étalant sur des boîtes de Pétri avec des Bactéries indicatrices des souches B et K12. L'absence de plages de lyse sur Bactéries K12 montre que les phages sont bien mutants (seuls les virus rII+ s'y multiplient). Les plages formées sur Bactéries B permettent de quanti-fier la récolte et de vérifier qu'il s'agit bien de mutants [rII] (grandes plages).
On observe donc ce que l'on s'attendait à trouver la descendance d'un mutant [rIIx] est constituée de virus du même type. Mais on remarque en outre que, dans la plupart des cas, il apparaît aussi des phages capables de se multiplier sur Bactéries de souche K12, c'est-à-dire des virus ayant le phénotype [rII+]. Le nouveau type se révèle stable et héréditaire, et on peut dire que le processus qui a conduit à l'apparition d'un individu de phénotype "sauvage" à partir d'une population de mutants cor-respond à la définition qu'on a donnée précédemment d'une mutation. On désigne les mutations qui permettent la restauration du phénotype " sauvage à partir d'une souche mutante par le terme général de réversions.
Il existe, en fait, plusieurs types de mutations qui peu-vent permettre l'apparition de souches révertantes. En effet, l'analyse de nombreux révertants a montré qu'une partie seulement d'entre eux avaient un génotype "sauvage".
On dit que la deuxième mutation supprime l'effet de la première et, de ce fait, on la désigne par le terme de suppresseur.
En règle générale, les fréquences de réversion sont très faibles, 'du même ordre que les fréquences de muta-tion ou plus petites. D'autre part, en comparant les fré-quences de réversion d'un certain nombre de mutations, on a pu établir que certaines reversaient relativement plus fréquemment que d'autres. Il est possible d'expliquer ce phénomène en postulant que plus la taille d'une mutation est petite, plus la mutation réverse est facile à obtenir. En effet, on conçoit bien que, si une mutation consiste en un changement au niveau d'un seul nucléotide de l'ADN, il est facile de rétablir la séquence de bases pri-mitive. Par contre, Si la mutation de départ consiste en une grande délétion impliquant plusieurs dizaines ou cen-taines de nucléotides, il est évident que la restauration de la séquence complète de l'ADN est un événement hautement improbable.
Il est possible de faire varier les conditions de telle sorte qu'une même Bactérie soit infectée en moyenne par un seul ou par plusieurs virus; il suffit de jouer sur les concentrations relatives des Bactéries et des virus (mul-tiplicité d'infection). Il est donc possible de réaliser des infections mixtes, dans lesquelles une Bactérie est infectée par deux phages provenant de deux souches différentes, et d'observer la récolte ainsi obtenue. Il s'agit, on le voit, d'un système expérimental très simple et très facile à utiliser.
D'un point de vue génétique, une infection mixte d'une Bactérie par deux virus de souches différentes constitue bien ce qu'on peut appeler un croisement, par analogie avec le phénomène désigné par ce terme chez les orga-nismes supérieurs. En effet, il y a réunion dans un même cytoplasme (celui de la Bactérie infectée) du matériel génétique provenant de deux parents distincts (qui peuvent être de génotype différent), puis génération de descendants chez lesquels on peut observer la transmis-sion des caractères des parents. L'infection mixte d'une Bactérie par deux mutants du système rII peut être sym-bolisée comme un croisement : rII X rlly.
Faisons le point de la situation. Nous sommes en pré-sence d'un grand nombre de souches mutantes rII1, r112, etc., présentant des phénotypes analogues. On vient de voir qu'il était possible de réaliser des croisements entre les différentes souches. Il est donc possible d'ana-lyser génétiquement le système rII ; cette analyse doit permettre de répondre clairement à plusieurs questions.
- De combien de gènes se compose le système rII ?
- Comment sont-ils disposés les uns par rapport aux autres?
- Combien y a-t-il de sites mutants?
- Comment sont-ils disposés à l'intérieur des gènes?
La méthodologie génétique est du type analytique: elle tend à " disséquer " un problème pour le séparer en ses composants les plus petits possibles, à résoudre séparément chacune des parties, puis à effectuer la syn-thèse de toutes les données pour expliquer l'ensemble, dans tous ces aspects.
Dans le cas des mutants rII, comment procéder pour répondre à la première question, c'est-à-dire comment déterminer le nombre de gènes dont se compose le système rII ? La méthode va consister à prendre les diffé-rents mutants deux à deux et, pour chaque couple de souches, à effectuer une expérience destinée à montrer Si les deux mutations sont dans le même gène ou dans des gènes différents. Cela revient à savoir si les deux gènes mutants que l'on met en présence sont allèles ou non. Ce type d'expérience s'appelle un test fonctionnel d'allélisme ou encore test de complémentation.
Le principe du test de complémentation consiste à réunir dans un même cytoplasme les génomes de deux mutants différents. Si chacune des deux souches ne possède qu'un seul gène mutant, il n'y a que deux situations possibles
- Les mutations sont situées dans des gènes différents.
Une Bactérie est infectée par deux virus; le génome du premier contient le gène C sous une forme mutante, et le génome du second contient le gène A sous une forme mutante. En d'autres termes, le premier génome ne pourra pas assurer la fonction cellulaire contrôlée par le gène C, et le deuxième celle contrôlée par le gène A. Cependant Si les deux génomes sont dans le même cytoplasme, ce qui est le cas lors d'une infection mixte, le gène A, intact du premier virus peut suppléer à la déficience du second et le gène C, intact, du deuxième peut suppléer à la déficience du premier. Le stock enzymatique contenu dans le cytoplasme de la Bactérie est complet il contient aussi bien l'enzyme E1 (qui dépend du gène A) que l'en-zyme E3 (qui dépend du gène C). Le résultat final est que l'ensemble des fonctions cellulaires est assuré. On dit alors que les deux souches mutantes se complémentent S'il s'agit de mutants [rll],on effectue des infections mixtes sur des Bactéries de la souche K12, sur lesquelles aucun des mutants n'est capable de se développer. Si les mutants présentent de la complémentation, une infection mixte donnera lieu à une récolte. Il est possible de vérifier que cette récolte résulte bien d'une complémentation (et non d'une réversion). Pour cela, on prend les phages de la récolte et on regarde s'ils sont toujours mutants en s'en servant pour infecter des Bactéries K12. On effectue l'in-fection avec une multiplicité d'infection telle qu'une Bactérie soit infectée par un seul phage. pour éviter des récoltes dues à la complémentation. On observe alors que les phages sont toujours mutants car ils ne sont pas virulents vis-à-vis des Bactéries K12. On constate cepen-dant, avec une très faible fréquence, l'apparition de quelques phages [rII+]. Nous verrons plus loin l'explica-tion de ce phénomène.
- Les mutations sont situées dans le même gène.
Dans une Bactérie infectée par deux virus, tous deux mutants pour le gène C, la fonction cellulaire contrôlée par ce gène ne peut être assurée par aucun des deux génomes en présence. Il n'y aura pas de complémenta-tion. En règle générale, on peut dire qu'il n'y a pas de complémentation entre deux gènes allèles. S'il s'agit de mutants [rII] du même gène, on n'obtiendra pas de récolte de virus lors d'infections mixtes de Bactéries K12.
Les raisonnements ci-dessus sont réversibles : il suffit, dans la plupart des cas, d'observer de la complé-mentation entre deux mutants pour conclure qu'ils sont situés dans deux gènes différents. De même, une absence de complémentation entre deux mutants est un bon argument en faveur de leur allélisme.
L'ADN des Papillomavirus est intégré au génome Les antigènes de capside se retrouvent dans les verrues (générées par certains HPV), pas dans les autres tissus.
HPV 16 et 18 sont responsables de 90% des cas de lésions urogénitales, carcinomes épidermiques invasifs. Les types de tumeurs.
Les infections à papillomavirus humains de type 16 sont fréquentes et le plus souvent asymptomatiques. La présence de ce génotype est cependant d'autant plus fréquente qu'il existe des modifications du col évoluant vers des lésions de haut grade. Une surveillance accrue des femmes porteuses saines du virus paraît indispensable. (P. M.)
a) Particules virales, isolées d'une verrue, observées après coloration négative à l'acide phosphotungstique.
b) Virions observés dans le noyau d'un kératinocyte des couches superficielles de l'épithélium malpighien. Colora-tion par l'acétate d'uranyl et le citrate de plomb.
(La barre correspond à 100 nm.)
Les papillomavirus sont des petits virus oncogènes non enveloppés constitués d'une molécule d'ADN entourée d'une capside de symétrie cubique. Grâce aux progrès de la biologie moléculaire, 60 génotypes de papillomavirus humains (HPV) ont été' à ce jour, isolés et caractérisés [2]. Vingt-quatre de ces génotypes infectent la muqueuse génitale. Certains de ces génotypes sont appa-rus ces dernières années comme l'agent étiologique le plus probable des cancers du col de l'utérus.
Bien qu'une infection virale associée à une hyperestro-génie locale persistante ait été suspectée dans la cancéro-genèse du col utérin par Ayre dès 1960 [I], ce n'est qu'en 1976 que les papillomavirus ont été associés au dévelop-pement de ce cancer par Zur Hausen [15]. En l'absence d'un test sérologique ou d'un système de culture cellulaire permettant l'isolement du virus. le diagnostic des infec-tions génitales à papillomavirus a été établi par le passé sur des critères cliniques, cytologiques et histopathologi-ques. Les infections à HPV du col utérin peuvent être cliniquement inapparentes. sinon elles se traduisent par des condylomes plans. le plus souvent associés aux néoplasies intra-épithéliales cervicales. ou, plus rarement, par des condylomes acuminés. La cytologie a permis de rattacher aux HPV des anomalies cellulaires caractéristi-ques rencontrées chez 1 à 3 p. 100 des femmes dans la population générale.
Cinq des 24 génotypes de papillomavirus génitaux infectent de façon prédominante la muqueuse génitale. Trois, HPV 6, HPV 1 let HPV 42, sont responsables de la majorité des lésions génitales de bas grade (condylomes et certaines dysplasies légères). Deux autres. HPV 16 et HPV 18. sont associés à la majorité des lésions malpi-ghiennes intra-épithéliales de haut grade (dysplasies moyennes. dysplasies sévères et cancers in situ) et aux cancers invasifs du col de l'utérus. Toutefois ces diffé-rents génotypes peuvent être rencontrés à la fois dans des lésions de bas grade, des lésions précancéreuses, ou cancéreuses.
A l'heure actuelle, la détection des infections à HPV repose sur les techniques d'hybridation des acides nucléi-ques. qui sont longues. coûteuses. délicates et réservées à des laboratoires spécialisés. A l'aide de la technique de transfert-hybridation (Southern blot), l'HPV 16 est détec-té dans 40 à 70 p. 100 [6, 8, 9, 14] des carcinomes épidermoïdes et des adénocarcinomes du col utérin.
L'amplification génique in vitro, technique de détec-tion des virus la plus sensible. a été récemment utilisée pour détecter les infections à papillomavirus de type 16 [4.5, 11.12, 13]. Une très haute fréquence d'infection à HPV 16 a été observée dans la population anglaise (11]. avec 2 sous-types a et b, le sous-type a étant seulement associé aux cancers du col. Bien que l'existence du sous-type b soit actuellement mise en cause, l'HPV 16a semble très fréquent et variable suivant les études ou l'origine des échantillons. Ainsi, une infection à HPV I 6 a été décelée dans 8 à 66 p. 100 de la population générale anglaise [Il, 13], dans 4p. 100 aux Pays-Bas [12] et 10 p. 100 aux Etats-Unis [5]. L'HPV 16 est également détecté chez 34 à 61 p. 100 des femmes ayant une dyspîasie et chez 80à 100 p. 100 des femmes ayant un cancer du col [4, 12].
Nous avons recherché la présence des papillomavirus de type 16 dans la population tourangelle en utilisant la technique d'amplification génique in vitro dans le but d'estimer la fréquence de cette infection en France.
La population étudiée est constituée de 126 femmes dont 41 (groupe A) venues consulter pour un examen de dépistage systématique et de 85 malades reçues au CHRU de Tours pour
un traitement par laser C02. après examen cytologique et histopathologique ayant montré une lésion à HPV. Toutes les femmes du groupe A avaient un examen cytologique normal ainsi que 27 des 85 (31,8 p. 100) femmes adressées pour traitement par laser mais qui. le jour du traitement, n'avaient plus aucune image cytopathologique évocatrice d'une infection à HPV (groupe B). Parmi les 58 femmes ayant des lésions malpighiennes intra-épithéliales. 29 avaient des lésions de faible grade et 29 de haut grade suivant le classement de Bethesda [10].
Chaque femme a fait l'objet d'un prélèvement de cellules du col utérin à l'aide d'une spatule dÀyre. Sur chaque prélèvement ont été réalisés un frottis coloré suivant la méthode de Papanico-laou. et une extraction de l'ADN pour l'amplification génique in vitro d'un fragment de génome de 1'HPV 16. Cette extraction est réalisée suivant la technique de Dykes modifiée [3]. Les amorces utilisées dans la réaction d'amplification génique sont celles décrites par Tidy et coîl. [11]. La spécificité des produits amplifiés a été établie par transfert-hybridation en utilisant une sonde froide marquée à la digoxigénine.
Parmi tous les échantillons analysés, aucun n'a montré une infection par le "sous-type HPV 16b" défini par Tidy et coll. [Il] et correspondant à une délétion de 21 paires de base de la région amplifiée du génome viral (fig. 2).
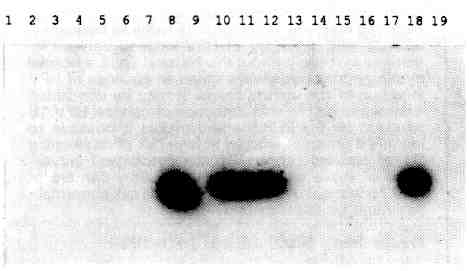
Les prélèvements 8.10, 11.12 contiennent un papillomavi-rus de génotype 16. Le témoin négatif est en position 1 et le témoin positif en position 18.
Une infection par 1'HPV 16 a été détectée chez 7 p. 100 des femmes sans antécédent d'infection à HPV et ayant un frottis cervical sans signe pathognomonique d'une infection à papillomavirus (groupe A). Une plus forte proportion (15 p. 100) est observée chez les femmes ayant des antécédents de lésions génitales à papillomavirus mais ayant un frottis normal au moment de la recherche virale (groupe B). Une infection à HPV 16 a été détectée chez 40 p. 100 de l'ensemble des femmes ayant des lésions malpighiennes intra-épithéliales. La proportion la plus forte (48 p. 100) a été observée chez les malades ayant des lésions de haut grade. La taille de l'échantillon ne permet pas d'observer une différence significative de fréquence d'infection à HPV 16 entre les lésions de haut grade et de bas grade.
Cette étude met en évidence la fréquence élevée des infections à papillomavirus de génotype 16 dans la population française étudiée et confirme son association très étroite avec les lésions malpighiennes intra-épithé-hales du col utérin. En accord avec la plupart des résultats d'Europe et des Etats-Unis, il apparaît que 5 à 10 p. 100 de la population des femmes adultes ont une infection aiguë ou chronique par l'HPV 16 sans lésion colposcopi-que ni anomalie cytologique décelable. De plus, près de la moitié des femmes ayant des lésions malpighiennes intra-épithéliales du col utérin a une infection à HPVI6. D'autres auteurs [4. 12] ont détecté l'HPV 16 par amplification génique in vitro dans 23 des 27(85 p. 100) cancers du col qu'ils ont étudiés. Il apparaît que la détection de l'HPV 16 est fonction de la présence et de la gravité de la lésion. Ces données suggèrent que les différentes lésions cervicales à HPV 16 sont des étapes progressives d'un processus histopathologique induit par le même agent étiologique.
Des résultats obtenus, on peut conclure que la détection de l'ADN du papillomavirus de génotype 16 par amplifi-cation génique in vitro permet d'identifier, parmi la population générale. un groupe de femmes à haut risque de développer des lésions précancéreuses ou cancéreuses du col utérin.
Une surveillance cytologique régulière doit être mise en oeuvre chez ces femmes qui sont des porteuses asympto-matiques du virus.
I. .Ayre J.E. s Role of the halo ceIl n cervical cancerigenesis: .4 virus manifestation in premalignancy7 Obster. Gynecot. 1960. I 7. 1 75- 182.
2. De Villiers E.Nl.: Heterogeneitv, ofthe human papillomavirusgroup.
f Virot, 1989. 63.4898-4903.
3. Dykes D.D.: The use of biotynilated DN.A probes in parentage testing: non-isotopic label mg and non-toxie extraction. Electropho-resis, 1988. 9.359-368.
4. Johnson M.À.. Blomfield P.I.. Bevan 1.8.. Young L.S.. Woodman
C.B. : Subtypes of humain papillomavirus 16 in cervical tissue.
Lancer. 1989. i 1342.
5. Manos M.. Lee K.. Greer C. et cou.: Looking for human papilloma-virus type 16 by PCR. Lancet. 1990. i 734.
6. Maenwell C.A.. Cox M.F., Blackledge G., Maitland NI. : HPV 16 DNA in normal and mal ignant cervical epithelium: implications for the aetiology and behaviour of cervical neoplasia. Lancer. 1987. i.
703-707.
7. Meisels .4.. Morin C.. Casas-Cordero M.: Human papulomavirus andcanceroftheuterinecervix. Inti Gynecot Pathology. 1982. I.
75-94.
8. Munoz N.. Bosch F.X.. Jensen O.M.: Human Papillomavirus and cervical cancer. [ARC Scientifique Pubi. n' 94, Lyon, 1989.
9. Reeves W.C.. Caussy D.. Brinton L..4. et cou. : Case-control study of human papillomavirus and cervical cancer in Latin .4merica. Int. f Cancer. 1987.40.450-454.
10. The 1988 Bethesda System for reporting cervical/vaginal cytologie diagnoses. Acta cytologica. 1989.33.567-574.
11.Tidy 1.4.. Vousden K.H.. Farrel PI.: Relation between infection with a subtype of HPV 16 and cervical neoplasia. Lancer, 1989.
1225-1227.
12. VanderBrule,4.I.C,.ClaasE.C.I..du Maine M.. MelchersW.I.G.eC coîl.: Use of anticontamination primers in the polymerase chain reaction for the detection of human papillomavirus genotypes in cervical serapes and biopsies. f Med. Virot. 1989,29, 20-27.
13. Ward P.. Parry> G.N.. Yule R.. Coleman DV.. Malcolm A.D.B.:
Human papillomavirus subtype 16a. Lancer. 1989. i. 170.
14. Yoshikawa H.. Matsukura T.. Yamamoto E.. Kawana T.. Mizuno
M.. Yoshike K.: Occurenceofhuman papillomavirus type l6and 18
DN.A in cervical carcinomas from Japon: Age pf patients and
histological type ofearcinomas. Jpn. J. Cancer Res.. 1985. 76,667-
671
15. Zur Hausen H.: Condylomata acuminata and human genital cancer.
Cancer Res.. 1976.36. 794.
Leur diagnostic ne s'effectue pas sur culture cellulaire.
-Hybridation in situ, sur coupes frottis.
-Southern. digestion ADN génomique - Western blot sur nitrocellulose - sonde spé d'ADN
viral.
-PCR: ampli t spé d'ADN viral - sonde virale oemplémentaire Pb d'ampli non spécifiques
L'lNF (interféron) aIfa marche pour les immunodéprimés, les HPV laryngés, mais il y a récidive à la fin du traitement!
Les herpès-virus sont des virus à ADN formés d'une particule centrale ("core" des Anglo-Saxons) composée de l'acide nucléique viral associé à des protéines selon un arrangement rotoïd

e, particule contenue dans une capside icosaédrique à 162 capsomères. Le tout est entouré d'une enveloppe dérivée de la membrane cellulaire. Ces virus sont volontiers à
En zone tropicale, l'herpès récurrent de l'adulte (herpès de "sortie") dû à Herpes simplex virus n'a rien de singulier. Il en va autrement de la primo-infection herpétique. En Europe, elle est asymptoma-tique dans plus de 90 p. 100 des cas; les rares formes patentes sont polymorphes et presque toujours bénignes: toutefois chez le nouveau-né prématuré, on observe parfois des formes septicémiques mortelles. Sous les Tropiques, notamment en Afrique noire, les primo-infections herpétiques patentes se rencontrent avec une fréquence inhabituelle et les formes générali-sées mortelles sont loin d'être exceptionnelles.
En zone tropicale, la primo-infection herpétique survient entre 3 mois ci 6 ans (avant 3 mois, le nourrisson est protégé par les anticorps maternels). Il existe souvent un ou plusieurs facteurs favorisants ou déclenchants: dénutrition, hypotrophie, surtout maladies infectieuses communes de l'enfance: rougeole (14 p. 100 des rougeoles hospitalisées à Dakar se compliquent de primo-infection herpétique), mais aussi diphtérie, coqueluche.
Forme habituelle. C'est celle du nourrisson ou du jeune enfant convalescent d'une rougeole. L'attention est attirée par la reprise de la fièvre (vers 38-39 °C), l'apparition d'une dysphagie ou d'un refus de l'alimentation. La gingivostomatite herpétique est caractéristique les gencives sont rouges, parfois ulcérées; les muqueuses jugales, palatines et linguales sont le siège de lésions vésiculeuses (vésicules contenant un liquide clair, parfois groupées en bouquet), puis aphtoïdes (par confluence et flétrissure des vésicules), enfin ulcéro-pultacées. Les lésions s'étendent pendant 3 à 5 jours, puis restent stationnaires pendant une dizaine de jours avant de se cicatriser; elles peuvent se surinfecter et durer plus longtemps encore. Cette gingivo-stomatite est douloureuse; elle gêne l'alimenta-tion et entraîne chez l'enfant déjà affaibli par la rougeole. une dénutrition et une déshydratation sévère.
Elle s'accompagne de fièvre, d'adénopathies satellites sensibles, parfois d'un herpès cutané péri-buccal.
Formes cliniques. L'angine herpétique l'herpès génital primaire sont rares. L'herpès oculaire primaire réalise une conjonctivite aiguë, une kératite linéaire ou stellaire et plus rarement un ulcère cornéen polycyclique. La récidive est fréquente et des séquelles à type de cicatrices ou de talcs compromettent souvent définitivement la vision. L'atteinte oculaire est isolée ou associé a un herpès buccal. Les formes malignes du nourrisson sont particulières a l'Afrique noire s elles débutent par un syndrome infectieux sévère et des lésions cutanées ou muqueuses florides; rapidement on assiste, impuissant, à l'aggravation du syndrome infectieux et à l'apparition d'atteintes viscérales s l'hépatite est la plus fréquente, mais il peut s'agir de méningite, d'encéphalite, d'atteinte pulmonaire. Ces formes sont presque toujours fatales.
L'herpès cutanéo-muqueux chronique péri-oral et surtout périnéal se voit au cours du SIDA.
la gingivo-stomatite herpétique doit être distinguée du muguet. de la stomatite de Vincent, des ectodermoses pluriorificielles. du syndrome de Stevens-johnson, des stomatites virales (coxsackie). des plaques muqueuses du bejel et des chéilites avitaminosiques.
Le cytodiagnostic sur le prélèvement d'une lésion permet un diagnostic simple et rapide par mise en évidence de cellules ballonnisées, cependant non spéci-fiques.
On peut isoler le virus en 48 heures sur culture de tissu ou rechercher une ascension significative du taux des anticorps â quelques semaines d'intervalle.
La 5-iodo-2-désoxyuridine (lduviran®) est active sur les localisations cutanées ou cornéennes s on l'utilise sous forme de collyre pour l'oeil et de gel sur la peau;
les applications doivent être répétées toutes les 2 heures. Elle n'est pas utilisable dans les atteintes buccales et viscérales. L'aciclovir (Zovirax®) est également efficace en pommade ophtalmologique, sur les lésions oculaires, niais surtout, &le peut être utilisée par voie générale pour le traitement des localisations profondes. Le traitement symptomatique est capital prévention des surinfections à l'aide de solutions antiseptiques. alimentation et réhydratation des nourrissons. au besoin par voie parentérale.
Les maladies tropicales | génétique | Les défenses du corps | micobiologie