I - Généralités sur les anticorps monoclonaux:
Parmi les méthodes d'étude du polymorphisme, les méthodes immunologiques sont les plus employées.
La propriété la plus importante des anticorps est de se lier aux substances qui ont stimulé leur synthèse en reconnaissant des déterminants allotypiques.
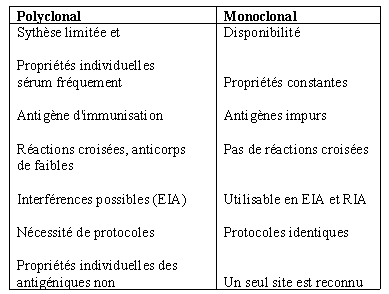
Les anticorps monoclonaux peuvent être employés de manière analogue aux anticorps polyclonaux conventionnels (tableau 1). Ils présentent quelques défauts mineurs et plusieurs avantages majeurs: ils peuvent avoir, en principe, une spécificité prédéterminée permettant la découverte de molécules indétectables par les polyséra conventionnels et représentent un important progrès en terme de détection ou de purification. Au cours de leur production, ils ne changent pas de structure. Ils peuvent être produits en quantités théoriquement illimitées. Les cellules productrices peuvent être conservées aisément dans l'azote liquide et remises en culture à la demande.
Ces divers aspects des anticorps monoclonaux produits par les hybridomes en font, en médecine, en biologie et dans l'industrie, un outil extrêmement utile.
Tableau 1: comparaison des propriétés de systèmes monoclonaux et polyclonaux
Ils peuvent être employés dans les trois domaines suivants, aussi bien dans les domaines de la biologie animale que végétale (Cf. annexe):
-définition d'antigènes et caractérisation d'épitopes,
-détection, localisation et quantification de molécules,
-purification.
II - Caractérisation de la spécificité:
marquage des anticorps
II.1 - Prélèvement de cellules lymphoïdes:
Dans le cas de la maladie de Marek qui infecte les poules, un anticorps monoclonal reconnaissant les molécules de classe I du C.M.H pourra être testé sur des cellules sanguines et lymphoïdes isolées. Ces dernières proviennent des organes spécialisés que sont la bourse de Fabricius (BF), la Rate (R), le Thymus (T). Ces organes, sont prélevés dans du PBS (1X), puis broyés au pilon sur une grille fine.
Une centrifugation de 4 min. à 400 rpm à 4° C sédimente les plus gros débris, le surnageant est centrifugé pendant 10 min. à 1200 rpm à 4° C.
De la même manière que précédemment, les cellules sont numérées sur lame de Thoma, mais sans nécessité de dilution des globules blancs.
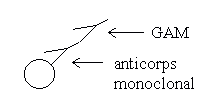
L’anticorps monoclonal (issu d'hybridomes de souris) est testé sur les érythrocytes et les cellules lymphoïdes, puis révélé par un deuxième anticorps anti-souris: G.A.M. (Goat anti-Mouse) couplé à un fluorochrome: le F.I.T.C. ou Fluoro Iso-Thio Cyanate de fluorescéine. La répartition de la fluorescence sur les différentes populations cellulaires indique les spécificités de fixation des anticorps monoclonaux à tester.
Pour chaque population cellulaire, un témoin est effectué, où l'anticorps monoclonal est remplacé par du G.A.M. non couplé au fluorochrome .
Les cellules soumises à l'excitation laser du F.A.C.S., présentent en effet une fluorescence naturelle, dont la ligne de base établie par le G.A.M. permet de s'affranchir (figure 2-N).
Les cultures d'hybridomes d'une part, les suspensions cellulaires titrées d'autre part, sont centrifugées pendant 5 min. à 1200 rpm à 4° C afin de récupérer le surnagent monoclonal, et un culot de cellules. Chaque culot cellulaire est incubé 1h avec 95 µl de chaque milieu de culture d’hybridome à tester (contenant l’anticorps), en homogénéisant le tout. Pour l'échantillon témoin, l'anticorps est remplacé par 95 µl de G.A.M. Après centrifugation pendant 5 min. à 1200 rpm, les sites cellulaires non fixés à l'anticorps sont saturés par du PBS (1X)-BSA (1%). Une nouvelle centrifugation de 5 min. à 1200 rpm permet de récupérer le culot de cellules.
Le marquage est effectué par 95 µl de G.A.M (Goat Anti- Mouse)-F.I.T.C. pendant 1h. Deux lavages au PBS sont suivis d'une centrifugation de 5 min. à 1200 rpm à 4°C.
L'intensité du marquage par le surnageant monoclonal est alors mesurée à l'aide du F.A.C.S.
II.2 - Mesure de l'intensité de marquage au F.A.C.S.
Le F.I.T.C (figure 2-C), n'est associé qu'aux cellules dont une des structures antigéniques (ou épitopes) a été reconnue par l'anticorps monoclonal à tester.
Sous l'influence d'un faisceau laser, les molécules de F.I.T.C. sont excitées et vont émettre, en se désexcitant, un rayonnement fluorescent, traduisant la quantité d'épitopes ayant fixé l'anticorps (figure 2-F). L'intensité de ce rayonnement -ou intensité de marquage- est mesurée à l'aide du Fast Assay Cytométric Sorter ou F.A.C.S, qui permet en outre de numérer les cellules.
Un détecteur (figure 2-D) capte les deux types de rayonnements (du F.I.T.C. et des cellules) qui sont transmis à un intégrateur (figure 2-I); celui-ci ne prend en compte que le rayonnement du F.I.T.C. en ôtant la fluorescence témoin (figure 3).
Figure 3: Constitution du témoin de fluorescence, dont le GAM n'est pas couplé au FITC
III- Caractérisation de la classe d'anticorps monoclonaux selon la méthode d'immunodiffusion d'Ouchterlony:
Le système (double diffusion sur gélose) consiste à faire diffuser les antigènes (ici des anti-Immunoglobulines -Ig-) et les anticorps à partir de puits creusés dans une couche de gélose coulée sur une lame de verre (figure n°4).
Les solutions diffusent librement dans le gel et donneront un arc de précipitation à la zone d'équivalence si l'anticorps et les anti-IgG sont de structures complémentaires.
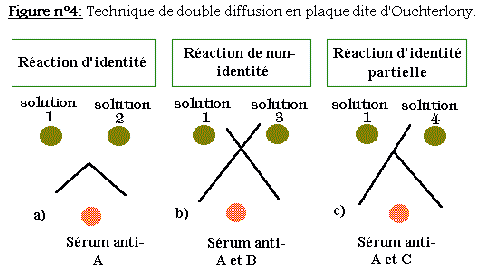
a)Une réaction d'identité: les solutions 1 et 2 contiennent le même antigène A qui donne avec l'antisérum deux lignes de précipitation, qui sont identiques d'un point de vue sérologique.
b) Une réaction de non-identité: la solution 1 et la substance B de la solution 3 sont sérologiquement différentes, les complexes immuns précipitent indépendamment.
c) Une réaction d'identité partielle: les déterminants antigéniques de A (solution 1) existent aussi dans la substance C (solution 4), mais que A possède en outre des déterminants antigéniques que C ne possède pas.
La technique d'Ouchterlony s'emploie ici avec différentes classes de G.A.M.: anti-IgG1, anti-IgG2a, anti-IgG2b, anti-IgG2ab, anti-IgG3a, anti-IgM (correspondant aux solutions 1, 2, 3, 4 de la figure 4). L'anticorps à étudier est placé dans le puits central, les anti-IgG dans les puits extérieurs.
Dans la recherche de la classe des anticorps monoclonaux, ceux-ci doivent, en principe, présenter des réactions d'identité correspondant à l'un des cas ci-dessus.
IV- Recherche du déterminisme moléculaire de l'anticorps monoclonal
Pour trancher entre le caractère anti-molécules du CMH-1 ou anti-espèce, les protéines de membrane des différents types cellulaires sont extraites, en vue d'effectuer une migration en SDS-PAGE (Sodium Dodecyl Sulfate-Poly Acrylamide Gel Electrophoresis) et de les conjuguer à l'anticorps monoclonal. La spécificité de fixation de l'anticorps sur les antigènes de classe I du C.M.H., à savoir soit sur la chaîne b2 microglobuline soit sur les chaînes Alpha, est déterminée par comparaison avec un étalon de poids moléculaire connu.
Technologies des Anticorps Monoclonaux